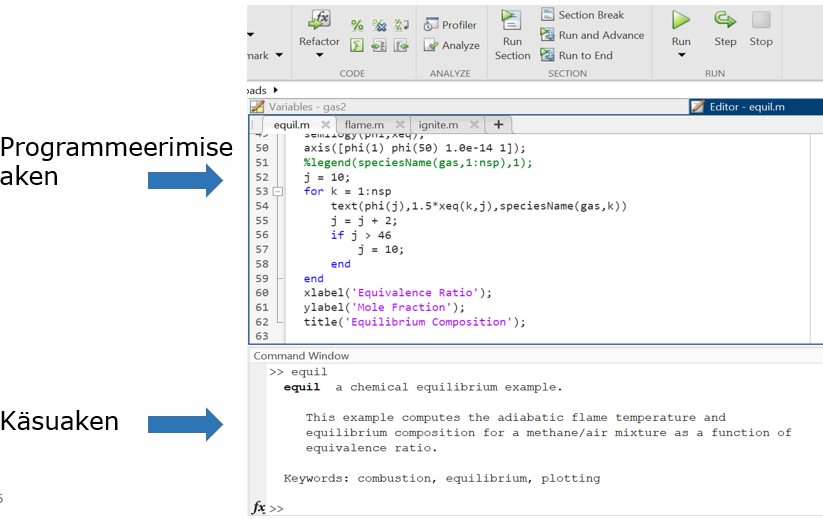
MatLabis kasutatakse koodi kirjutamisel kahte akent, programmeerimise aken ning käsuaken. Kui Command Windows (käsuaken) näha ei ole, siis saate selle lisada Layout nupu alt, Show >> Command History. Vahe seisneb selles, et programmeerimise aknas võib kirjutada mitu koodirida järjest ning lisada kommentaare. Tulemuste väljastamiseks vajutatakse rohelist nuppu RUN. Käsuaknasse kirjutatakse ühe koodirea kaupa ning tulemuste väljastamiseks tuleb vajutada ENTER. Töötamisel pole oluline, kuidas aknad paigutuvad. Paigutage need nii, nagu on mugav töötada. Näited mõlemast aknast on toodud järgnevalt:
2. Analüüs
1. Temperatuur ja rõhk
temperature 1500 K
pressure 1e+05 Pa
- Näide: Kui õhu temperatuur on toatemperatuuril 300 K, siis 1500 K on 5× kõrgem → molekulid liiguvad keskmiselt üle 2 korda kiiremini (kineetiline energia ~ T).
- Sellisel temperatuuril on CH₄ ja O₂ segu juba väga lähedal põlemisreaktsioonide algusele — kui reaktsioonid lubada, läheks segu kiiresti leekidesse.
2. Tihedus ja keskmine molaarmass
density 0.15422 kg/m³
mean mol. weight 19.234 kg/kmol
- Näide: Tavaline õhk merepinnal ja 300 K juures on ~1.2 kg/m³.
Siin on 0.15 kg/m³ → umbes 8 korda hõredam, sest gaas on palju kuumem.
- Keskmine molaarmass (19.234 g/mol) tuleb koostisest: CH₄ = 16 g/mol, O₂ = 32 g/mol, segu: 0.8·16 + 0.2·32 ≈ 19.2.
See on madalam kui õhul (29 g/mol) → seepärast on segu veelgi kergem.
3. Entalpia ja sisemine energia
enthalpy 6.4781e+05 J/kg
internal energy -607.91 J/kg
- Absoluutsed väärtused sõltuvad viitepunktist, mille Cantera valib NASA polünoomidest. Negatiivne sisemine energia ei ole “ebareaalne” – null on kokkuleppeline.
- Näide: Kui jahutada segu 1500 K → 300 K, muutub entalpia palju väiksemaks (Δh negatiivne) → see vastab eraldunud soojusele (gaas annab energiat keskkonnale).
4. Entroopia ja Gibbs’i vabaenergia
entropy 14618 J/kg-K
Gibbs function -2.1279e+07 J/kg
- Entroopia kõrge väärtus (14.6 kJ/kg·K) näitab, et osakestel on palju võimalikke mikroseisundeid.
- Gibbs’i vabaenergia g = h - Ts. Negatiivne suur väärtus tähendab, et süsteemil on väga suur potentsiaal teha reaktsioonides tööd.
- Näide: Kui lisad samasse mahusse veel hapnikku ja lase reaktsioonil kulgeda → Gibbs’i vabaenergia muutub veelgi negatiivsemaks → metaan põleb.
5. Soojusmahud ja γ
cp = 4140.9 J/kg-K
cv = 3708.6 J/kg-K
γ = cp/cv ≈ 1.12
- Suur cp = vaja palju energiat, et kuumutada 1 kg segu veel 1 K võrra → gaas neelab energiat.
- γ (1.12) on väiksem kui ideaalsel kaheatomilisel gaasil (≈1.4), sest siin on palju vabadusastmeid (CH₄ vibratsioonid, pöörded jne), mis neelavad energiat.
- Näide: Kui see gaas paisuks adiabaatiliselt (nt turbiinis), temperatuur langeks palju vähem kui γ = 1.4 puhul → seega vähem efektiivne paisumisprotsess võrreldes õhuga.
6. Koostis ja keemilised potentsiaalid
mass frac. Y: O2 = 0.33272, CH4 = 0.66728
mole frac. X: O2 = 0.2, CH4 = 0.8
chem. pot./RT: O2 = -29.406, CH4 = -33.67
- Segu on väga metaanirikas: tegelikult 8 korda rohkem CH₄ kui stoihhiomeetriliselt vaja (φ ≈ 8). See tähendab, et hapnik saab kohe otsa ja enamus CH₄ jääks põletamata.
- Keemilised potentsiaalid (μ/RT) näitavad, kui “kergesti” aine võib osaleda reaktsioonis. CH₄-l on madalam väärtus (−33.7) → termodünaamiliselt soodsam oksüdeeruda, kui O₂ on olemas.
- Näide: Kui põletad metaani täielikult: CH₄ + 2O₂ → CO₂ + 2H₂O, reaktsioonil on väga suur negatiivne ΔG → protsess on spontaanselt väga soodne.
Antud näidis oli loodud kasutades gri30.yaml sisendfaili. Cantera andmete hoidlas on olemas veel palju selliseid faile, kus on kirjeldatud erinevate ainete omadused, vaata joonist.