Cantera programmi kasutamine
| Õpikeskkond: | Eesti Maaülikooli Moodle |
| Kursus: | Simulatsioonid |
| Raamat: | Cantera programmi kasutamine |
| Printija: | Külaliskasutaja |
| Kuupäev: | esmaspäev, 26. jaanuar 2026, 02.32 AM |
Kirjeldus
MatLabis kasutatakse koodi kirjutamisel kahte akent, programmeerimise aken ning käsuaken. Kui Command Windows (käsuaken) näha ei ole, siis saate selle lisada Layout nupu alt, Show >> Command History. Vahe seisneb selles, et programmeerimise aknas võib kirjutada mitu koodirida järjest ning lisada kommentaare. Tulemuste väljastamiseks vajutatakse rohelist nuppu RUN. Käsuaknasse kirjutatakse ühe koodirea kaupa ning tulemuste väljastamiseks tuleb vajutada ENTER. Töötamisel pole oluline, kuidas aknad paigutuvad. Paigutage need nii, nagu on mugav töötada. Näited mõlemast aknast on toodud järgnevalt:
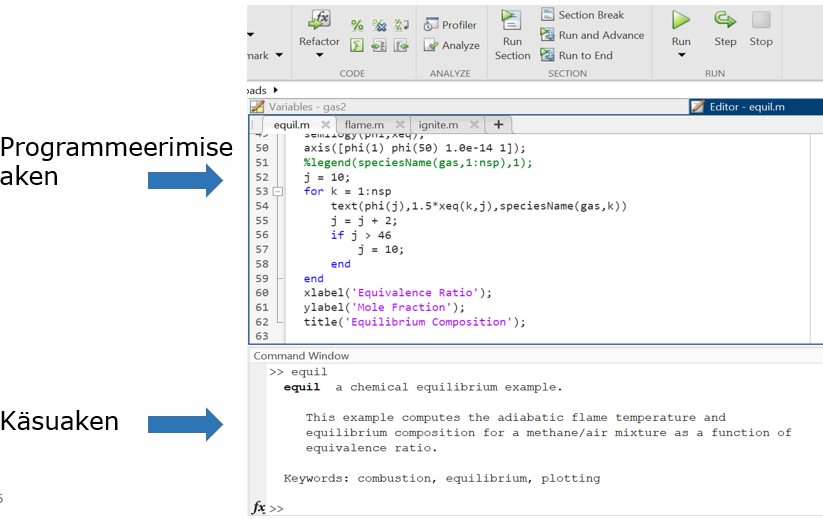
1. Käsuakna kasutamine:
MatLabi käsuaknasse sisestatakse kood:>> gas1 = GRI30
GRI30 on 53 keemilise ühendi ning 325 elementaarse keemilise reaktsiooni kogumik, mis oli loodud erinevate põlemisreaktsioonide simuleerimiseks. Ainete loetelu: Ar, C, C2H, C2H2, C2H3, C2H4, C2H5, C2H6, C3H7, C3H8, CH, CH2, CH2CHO, CH2(S), CH2CO, CH2O, CH2OH, CH3, CH3CHO, CH3O, CH3OH, CH4, CN, CO, CO2, H, H2, H2CN, H2O, H2O2, HCCO, HCCOH, HCN, HCNN, HCNO, HCO, HNCO, HNO, HO2, HOCN, N, N2, N2O, NCO, NH, NH2, NH3, NNH, NO, NO2, O, O2, OH.
Pärast käsu sisestamise vajutage ETER ning MatLabi käsuaknas tekib järgmine pilt:
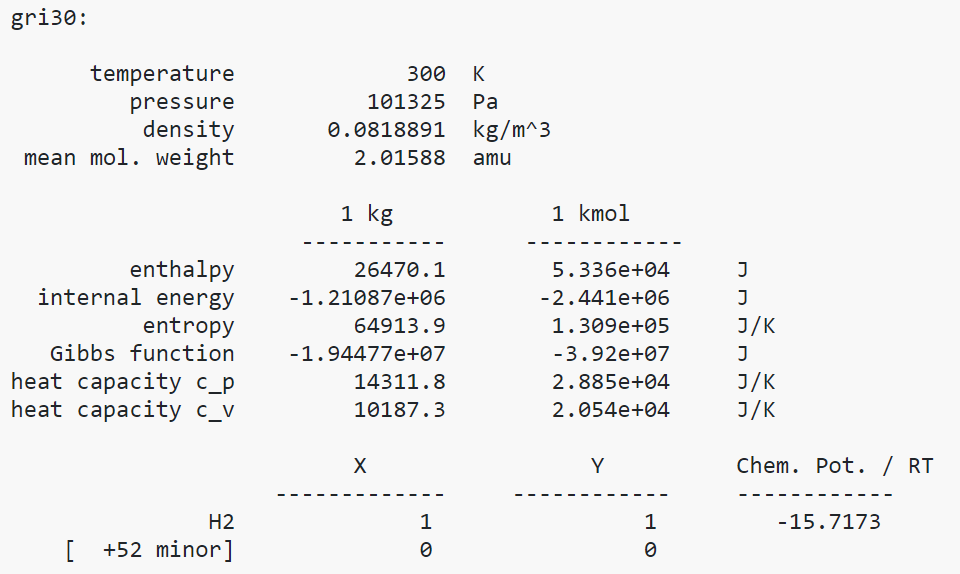
Joonis 7. Esmane näidis programmi kasutamisel.
Väljund gri30: kajastab erinevaid reaktsiooni tingimusi nagu temperatuur, rõhk, tihedus, siseenergia jne. Samuti on kajastatud aine faas ehk olek. Tingimustest on näha, et reaktsioon toimub normaaltingimustel. Koostise puhul on näha, et praegu on sisestatud ainult 1 komponent (H2/hapnik), ehk simuleeritud on vesiniku põlemise reaktsiooni hapnikuga. Antud koodi sisestamisel toimub reaktsioon alati hapnikuga. Tulemust väljendatakse 1 kg ja 1 kmol kohta.
Gaasisegu põlemise simuleerimiseks mingitel kindlatel tingimustel tuleb kasutada set() meetodit. Simuleerimisel ei ole võimalik määrata ainult ühte keskkondliku tingimust, näiteks temperatuuri, kuna temperatuur mõjutab ka rõhku ja tihedust. Termodünaamikast on tuntud, et lisaks koostisele, aine (või segu) oleku kindlaksmääramisele tuleb fikseerida vähemalt kaks keskkonna tingimust. Näidiseks, antud programmeerimiskomplektist (temperatuur, tihedus, massiosa) seadistamise ajal muutub ainult üks omadus. Täpsemalt:
- Temperatuuri seadistamine toimub tiheduse ja koostise fikseerimisel. (Rõhk muutub);
- Rõhu seadistamine toimub, hoides temperatuuri ja koostist fikseerituna. (Tihedus muutub);
- Koostise seadistamine toimub fikseeritud temperatuuri ja tiheduse hoidmisel. (Rõhk muutub).
Näiteks:
set() meetodi kasutamisel, käsuaknasse sisestatakse kood:
>> set(gas1, 'Temperature', 1500, 'Pressure', 1.e5, 'MoleFractions', 'CH4:1,O2:2');
Määratakse kindel temperatuur (1500K), rõhk (100000 Pa) ning gaasisegu koostis (metaan + hapnik). See tähendab, et metaani põlemine toimub hapniku keskkonnas. Tulemuste arvutamiseks tuleb sisestada käsk:
>> gas1()
Programm väljastab tulemused:

2. Analüüs
Cantera tulemuste selgitused (näide: CH₄ + O₂ segu)
1. Temperatuur ja rõhk
temperature 1500 K
pressure 1e+05 Pa
- Näide: Kui õhu temperatuur on toatemperatuuril 300 K, siis 1500 K on 5× kõrgem → molekulid liiguvad keskmiselt üle 2 korda kiiremini (kineetiline energia ~ T).
- Sellisel temperatuuril on CH₄ ja O₂ segu juba väga lähedal põlemisreaktsioonide algusele — kui reaktsioonid lubada, läheks segu kiiresti leekidesse.
2. Tihedus ja keskmine molaarmass
density 0.15422 kg/m³
mean mol. weight 19.234 kg/kmol
- Näide: Tavaline õhk merepinnal ja 300 K juures on ~1.2 kg/m³.
Siin on 0.15 kg/m³ → umbes 8 korda hõredam, sest gaas on palju kuumem.
- Keskmine molaarmass (19.234 g/mol) tuleb koostisest: CH₄ = 16 g/mol, O₂ = 32 g/mol, segu: 0.8·16 + 0.2·32 ≈ 19.2.
See on madalam kui õhul (29 g/mol) → seepärast on segu veelgi kergem.
3. Entalpia ja sisemine energia
enthalpy 6.4781e+05 J/kg
internal energy -607.91 J/kg
- Absoluutsed väärtused sõltuvad viitepunktist, mille Cantera valib NASA polünoomidest. Negatiivne sisemine energia ei ole “ebareaalne” – null on kokkuleppeline.
- Näide: Kui jahutada segu 1500 K → 300 K, muutub entalpia palju väiksemaks (Δh negatiivne) → see vastab eraldunud soojusele (gaas annab energiat keskkonnale).
4. Entroopia ja Gibbs’i vabaenergia
entropy 14618 J/kg-K
Gibbs function -2.1279e+07 J/kg
- Entroopia kõrge väärtus (14.6 kJ/kg·K) näitab, et osakestel on palju võimalikke mikroseisundeid.
- Gibbs’i vabaenergia g = h - Ts. Negatiivne suur väärtus tähendab, et süsteemil on väga suur potentsiaal teha reaktsioonides tööd.
- Näide: Kui lisad samasse mahusse veel hapnikku ja lase reaktsioonil kulgeda → Gibbs’i vabaenergia muutub veelgi negatiivsemaks → metaan põleb.
5. Soojusmahud ja γ
cp = 4140.9 J/kg-K
cv = 3708.6 J/kg-K
γ = cp/cv ≈ 1.12
- Suur cp = vaja palju energiat, et kuumutada 1 kg segu veel 1 K võrra → gaas neelab energiat.
- γ (1.12) on väiksem kui ideaalsel kaheatomilisel gaasil (≈1.4), sest siin on palju vabadusastmeid (CH₄ vibratsioonid, pöörded jne), mis neelavad energiat.
- Näide: Kui see gaas paisuks adiabaatiliselt (nt turbiinis), temperatuur langeks palju vähem kui γ = 1.4 puhul → seega vähem efektiivne paisumisprotsess võrreldes õhuga.
6. Koostis ja keemilised potentsiaalid
mass frac. Y: O2 = 0.33272, CH4 = 0.66728
mole frac. X: O2 = 0.2, CH4 = 0.8
chem. pot./RT: O2 = -29.406, CH4 = -33.67
- Segu on väga metaanirikas: tegelikult 8 korda rohkem CH₄ kui stoihhiomeetriliselt vaja (φ ≈ 8). See tähendab, et hapnik saab kohe otsa ja enamus CH₄ jääks põletamata.
- Keemilised potentsiaalid (μ/RT) näitavad, kui “kergesti” aine võib osaleda reaktsioonis. CH₄-l on madalam väärtus (−33.7) → termodünaamiliselt soodsam oksüdeeruda, kui O₂ on olemas.
- Näide: Kui põletad metaani täielikult: CH₄ + 2O₂ → CO₂ + 2H₂O, reaktsioonil on väga suur negatiivne ΔG → protsess on spontaanselt väga soodne.
Antud näidis oli loodud kasutades gri30.yaml sisendfaili. Cantera andmete hoidlas on olemas veel palju selliseid faile, kus on kirjeldatud erinevate ainete omadused, vaata joonist.
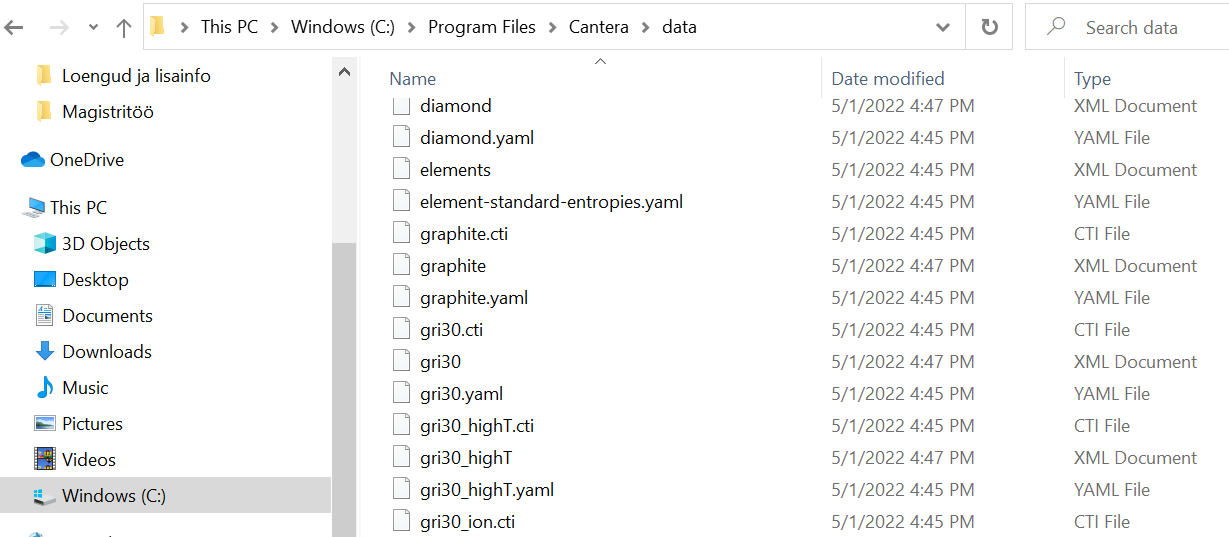
3. Mitme faasi (aine oleku) importimine ühest sisendfailist
Kasutades uuet sisendfaili diamond.yaml, saab näidata, kuidas on võimalik importida antud failist kahte põhifaasi ning nende omavahelist interaktsiooni.Käsuakna sisestatakse kood:
>> gas2 = Solution('diamond.yaml', 'gas');
Näitab, et faasiks on määratud gaas, solution meetod on alternatiivne viis, mida kasutatakse tulemuste väljastamiseks.
>> diamond = Solution('diamond.yaml','diamond');
Määrab teise faasi, tegemist on lahtise teemandiga.
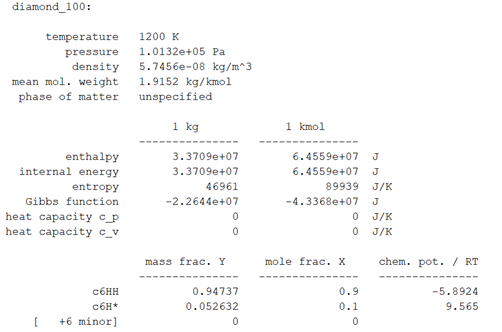
>> diamonnd_surf = importInterface('diamond.yaml','diamond_100', gas2, diamond);
Mõlema faasi omavaheline interaktsioon. Diamond.yaml on sisendfail, kust võetakse informatsiooni faaside kohta, diamond_100 on imporditava reaktsiooni nimetus, gas2 on esimene faas ning diamond on teine faas.
Programmi poolt väljastatud tulemus:
Selleks, et kustutada kõik eeltoodud koodid, tuleb sisestada käsuaknas:
>> clear all
Esimene kood kustutab kõik objektid, mis olid loodud MatLabi poolt ning kood
>> cleanup
kustutab objekte, mis olid loodud Cantera poolt.
4. Abi küsimine
Juhul, kui tekkis vajadus uurida, milliseid meetodeid saab veel kasutada mingi kindla funktsiooni/elemendi puhul, siis esiteks tuleb määrata tähistus. Näidis:
>> d = diamond
Järgmine käsk annab võimaluse teha selgeks millise klassi alla kuulub tähis „d“. Tähis „d“ kuulub „Solution“ alla:
>> class (d)
Programm annab vastuse:
ans = 'Solution'
Kasutades meetodi funktsiooni, saab näha täielikku nimekirja:
>> methods Solution -full [23]
Nimekiri näitab, et meetodit jagunevad kolme kategooriasse: kineetika, termodünaamika ja transport. Lisa informatsiooni saamiseks võib kasutada abi (help) funktsiooni.
